نگاهی به تاریخچه
طیف گسترده ای از فرآیندهای بسیار مهم در یک سلول زنده دارای ماهیت الکتروشیمیایی هستند. در هیچ جا طبیعت الکتروشیمی به اندازه پدیده های تولید و انتشار تکانه های عصبی کنترل کننده نیست.
مطالعه انگیزه عصبی سابقه ای غنی و حتی گاه دراماتیک داشته است. شاید بد نباشد در اینجا یادآوری کنیم که الکتروشیمی به عنوان یک علم به آزمایش های گالوانی (1798) برمی گردد که در نهایت منجر به کشف آنچه او "الکتریسیته حیوانی" نامید ، شد. دهه گذشته پیشرفت چشمگیری را در این زمینه آغاز کرد که به دلیل استفاده از روش های جدید بررسی غشای سلول و سیستم های مدل جدید و توسعه یک نظریه کمی حمل و نقل یونی ناشی از آن امکان پذیر شد. امروز ، اظهارنظر زیاد نیست که رویکرد جدید بیوالکتروشیمیایی برای مشکلات مربوط به عملکرد سیستم های بیولوژیکی پدید آمده است. ویژگی اصلی آن این است که توجه به طبیعت فیزیکی پدیده ها متمرکز شده است ، در حالی که بیشتر جزئیات با ماهیت متفاوت ، از نظر فیزیولوژی بسیار مهم است ، آگاهانه نادیده گرفته می شوند. بررسی حاضر دقیقاً از این راهنما پیروی می کند.
سابقه تاریخی معمولاً نسبت دادن منشأ مطالعه انگیزه عصبی به گالوانی که مشاهده انقباض عضله قورباغه در تماس با فلزات مختلف یا تحت تخلیه الکتریسیته جوی است مرسوم است ، اگرچه پدیده های بیوالکتریک از قدیم الایام برای مردان شناخته شده است. در روم باستان تخلیه ماهی های الکتریکی توسط پزشکان در برابر برخی بیماری ها تجویز می شد. فیزیکدانان مشهوری مانند فارادی ، ماکسول ، هلمهولتز ، هرتس و پلانک به پدیده های بیوالکتریک علاقه نشان دادند. سرعت تکانه فشار عصبی در قرن گذشته (هلموتز) اندازه گیری شد و در سال 1902 برنشتاین اولین توضیح الکتروشیمیایی قدرت الکتریکی را در غشای سلول ارائه داد. در سال 1939 هافمن یک مدار معادل برای غشای فیبر عصب پیشنهاد کرد که انتشار تکانه عصبی را به افزایش کوتاه مدت هدایت غشا نسبت می دهد. در سال 1949 کولن یک روش بستن ولتاژ (ولتاژهای ثابت در سراسر غشای فیبر عصبی) را اجرا کرد. روش وی در سال 1952 توسط هوچکین و هاکسلی رای انجام مطالعه دقیق جریانهای یونی از طریق غشای آکسون غول پیکر مرکب استفاده شد. کار آنها ، که برای آن جایزه نوبل دریافت کردند ، تحقیقات زیادی را آغاز کرد که هدف نهایی آنها تعیین ساختار و مکانیسم فعالیت سیستم های مولکولی مسئول حمل و نقل یونی و اثرات الکتریکی مربوطه بود.
اندازه گیری جریانهای به اصطلاح دروازه در آکسون غول پیکر توسط آرمسترانگ و بزانیلا که نقطه عطف مهم برای رسیدن به این هدف بود. جریان ها به دلیل حرکات ذرات باردار درون شاخه ای است که هدایت کانال های یونی را کنترل می کنند و در واقع قبلاً توسط هاجکین و هاکسلی بر اساس تئوری پیش بینی شده بودند.
تحقیقات اولیه در مورد "برق حیوانات"
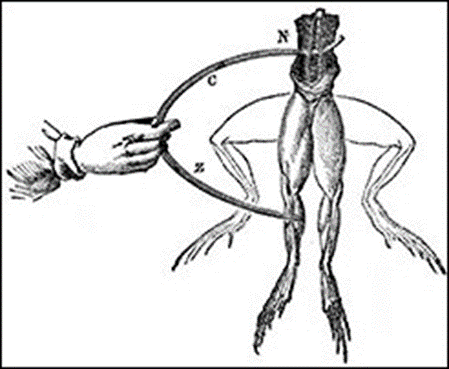
در سال 1730 استیون گری به دانش آموز مدرسه ای، الكتریسیته ساكن را در اولین آزمایش الكتریكی كه بر روی هر حیوان از هر نوع انجام شد ، تحمیل كرد. طی پنجاه سال آینده محققان دیگر دریافتند که لمس یک میله با بار الکتریکی می تواند باعث انقباض عضلات حیوانات مرده شود. این آزمایش ها ثابت نکردند که الکتریسیته عضلات را کنترل می کند ، اما آنها در اواخر قرن هجدهم لوئیجی گالوانی را متقاعد کردند که این مسئله شایسته تحقیقات بیشتر است.
گالوانی تلاش کرد تا نشان دهد که "برق حیوانات" واقعاً وجود داشته است. تا سال 1798 با اتصال عصب و عضله پای قورباغه با قوس فلزی و بدون افزودن برق ، موفق شد قورباغه ی مرده لگد بزند. دلایل این حرکت تا دهه 1840 هنوز نامشخص بود تا زمانی که ابزارهای حساس جدید به امیل دوبویز ریموند اجازه دادند نشان دهد که جریان های الکتریکی واقعاً از طریق عضلات و اعصاب جریان دارند. تغییر در شدت یا جهت جریان ها باعث انقباض عضلات می شود
 .
.
الکتروشیمیایی ضربه عصبی
طیف گسترده ای از فرآیندهای بسیار مهم در یک سلول زنده دارای ماهیت الکتروشیمیایی هستند. در هیچ جا طبیعت الکتروشیمیایی به اندازه پدیده های تولید و انتشار تکانه های عصبی کنترل کننده نیست. مطالعه انگیزه عصبی سابقه ای غنی و حتی گاه دراماتیک داشته است. شاید بد نباشد در اینجا یادآوری کنیم که الکتروشیمی به عنوان یک علم به آزمایش های گالوانی (1798) برمی گردد که سرانجام منجر به کشف چیزی شد که وی "برق حیوانات" نامید. دهه گذشته پیشرفت چشمگیری را در این زمینه آغاز کرد که به دلیل استفاده از روش های جدید بررسی غشای سلول و سیستم های مدل جدید و توسعه نظریه کمی حمل و نقل یونی ناشی از آن امکان پذیر شد.
امروز ، اظهارنظر زیاد است که رویکرد جدیدی - بیوالکتروشیمیایی - برای مشکلات مربوط به عملکرد سیستم های بیولوژیکی بوجود آمده است. ویژگی اصلی آن این است که توجه به طبیعت فیزیکی پدیده ها متمرکز شده است ، در حالی که بیشتر جزئیات با ماهیت متفاوت ، از نظر فیزیولوژی بسیار مهم است که آگاهانه نادیده گرفته می شوند.
ATP و انرژی زندگی
شیمی پشت این اثرات، امروزه با جزئیات بسیار بیشتری درک شده است. طبق نظریه غشای تحریک عصبی ، که در ابتدا توسط جولیوس برنشتاین در سال 1902 ارائه شد ، غشای نورونها (سلولهای عصبی) می توانند با انسداد یا انتقال انواع خاصی از یونها ، از نظر الکتریکی قطبی شوند. همانطور که دیوید ناچمنسون برای اولین بار در سال 1938 نشان داد ، این قطب بندی در امتداد عصب تا انتها حرکت می کند ، جایی که باعث ترشح ماده شیمیایی به نام استیل کولین می شود. این ماده شیمیایی باعث قطبی شدن سلولهای عصبی مجاور نیز می شود و انگیزه را به سمت مقصد خود اعم از عضله ، عصب دیگر یا اندام دیگر می فرستد. وقتی سیگنال عصبی به عضله می رسد ، باعث ایجاد زنجیره ای از واکنش های شیمیایی می شود که منجر به تجزیه مولکولی به نام آدنوزین تری فسفات (ATP) می شود. انرژی الکتروشیمیایی با تجزیه مولکول ATP آزاد می شود.
ATP منبع اصلی تأمین انرژی برای همه موجودات زنده است. این ماده در چرخه کربس ساخته می شود ، مجموعه ای از واکنش های شیمیایی سلولی که توسط هانس کربس در دهه 1930 کشف شد. هر سلول از یک گیاه یا حیوان از گلوکز (نوعی قند) برای ایجاد اختلاف بار الکتریکی در غشا استفاده می کند.
الکتروتراپی: شوک به سیستم وارد می شود
در طول قرن هجدهم و اوایل قرن نوزدهم ، برق کاملاً عصبی بود. پزشکان ، دانشمندان و همراهان - که همیشه به راحتی از یکدیگر متمایز نیستند - از شوک های الکتروشیمیایی برای درمان تقریباً هر بیماری قابل تصور استفاده کردند. آنها بیشتر اوقات در معالجه برخی از فلج ها با تحریک عضلات موفق می شدند و در اواسط قرن نوزدهم ، گیوم بنیامین دوشن دو بولون این روش را سیستماتیک می کرد. امروزه فیزیوتراپیست ها هنوز از الکتروتراپی برای فلج و سایر مشکلات جسمی استفاده می کنند.
مهمترین عضله تحت درمان با برق ، قلب است. به طور معمول ، پالس های برق منظم آن را با سرعت ثابت نگه می دارند. اگر مشکلی با نبض الکتریکی طبیعی وجود نداشته باشد ، ضربان سازهای مصنوعی که از دهه 1950 در دسترس هستند ، می توانند ضربان قلب بیمار را به طور مرتب حفظ کنند. درمان اضطراری ضربان قلب نامنظم را می توان توسط دستگاه جراحی قلب یا دفیبریلاتور انجام داد. در بعضی موارد یک لرزش برق از طریق قفسه سینه برای بازگرداندن ریتم های طبیعی کافی است.
پرهیز از چاقو
اثر مخرب عبور جریان الکتریکی از طریق بافت انسان (الکترولیز) نیز دارای کاربردهای درمانی است. در قرن نوزدهم جراحی یک امر بسیار خطرناک و دردناک بود. به جای برداشتن تومور از طریق جراحی ، پزشک می تواند از الکترولیز - که بعید به نظر می رسد منجر به مرگ در اثر عفونت یا شوک شود - برای کند کردن رشد و حتی توقف آن استفاده کند. با پیشرفت در روش جراحی ، الکترولیز دیگر متداول در درمان سرطان نیست ، اما هنوز هم به طور مداوم (تحت نام الکتروکوتر) برای جلوگیری از خونریزی عروق خونی کوچک استفاده می شود. متخصصان پوست همچنان از آن برای از بین بردن زگیل ، خال و مو استفاده می کنند.
تشخیص مشکلات سلامتی
علاوه بر درمان مشکلات سلامتی ، می توان از برق برای تشخیص آنها نیز استفاده کرد. دستگاه های ضبط کننده اکنون فعالیت الکتریکی طبیعی بدن را به نمودارهایی تبدیل می کنند که پزشکان سپس برای تجزیه و تحلیل مشکلات پزشکی استفاده می کنند. پزشکان اکنون ناهنجاری های قلب را با الکتروکاردیوگرام (ECG) ، اختلال مغزی با الکتروانسفالوگرام (EEG) و از دست دادن عملکرد عصب را با الکترومایوگرام (EMG) تشخیص می دهند.
-فناوری الکتروشیمیایی در بدن کار می کند.
پیشرفت های فن آوری این قرن ، الکتروشیمی را به روشی جدید وارد بدن کرده است. در دهه 1950 بیماران قلبی ضربان سازهای قلب خود را با چرخ دستی به اطراف هل می دادند. اکنون جراحان می توانند ضربان سازهای قلب را در داخل قفسه سینه بیمار قرار دهند.
امروزه ترانزیستورها و میکرو تراشه ها از اندازه دستگاه های الکترونیکی قابل کاشت می کاهند ، باتری های طولانی مدت آنها را تأمین می کنند و مواد بی اثر مانند تیتانیوم و فلزات غیربلور در برابر واکنش های الکتروشیمیایی داخل بدن مقاومت می کنند.
فناوری نیمه هادی در پزشکی امری عادی شده است. در کاشت حلزون از فناوری رایانه برای تحریک مستقیم عصب شنوایی استفاده می شود و برخی افراد کاملاً ناشنوا را قادر به شنیدن می کند. رایانه با استفاده از تصویر اشعه ایکس ، پزشکان را قادر می سازد تا بافت نرم مانند مغز را ببینند. در پزشکی ، مانند بسیاری از زمینه ها ، الکتروشیمی انقلابی در زندگی ما ایجاد کرده است.
سلول های عصبی
مطالعه علمی مغز و سیستم عصبی به نام علوم اعصاب و یا نوروبیولوژی است. بدن انسان از تریلیون سلول تشکیل شده است. سلولهای سیستم عصبی ، سلولهای عصبی یا نورونها نامیده می شوند و برای انتقال "پیامها" از طریق یک فرآیند الکتروشیمیایی، تخصصی هستند. مغز انسان تقریباً 86 میلیارد نورون دارد. نحوه انتقال پیام توسط نورون ها ، در پتانسیل عمل اتفاق می افتد.
سلول عصبی یا نورون عامل اصلی فعالیت سیستم عصبی است. سلول های عصبی اطلاعات را از نظر الکتریکی و شیمیایی منتقل می کند. درون خود نورون ، اطلاعات از طریق حرکت یک بار الکتریکی (یعنی یک ضربه) منتقل می شود. نورون دارای سه جز اصلی است: (1) دندریت ها ، رشته های نازکی که از سلول در ساقه های شاخه ای منشعب می شوند تا اطلاعات را از سلول های عصبی دیگر دریافت کنند. (2) بدن سلول ، که بیشتر عملکرد اصلی سلول عصبی را انجام می دهد. و (3) آکسون ، یک فیبر نازک و بلند که تکانه های عصبی را به سلولهای عصبی دیگر می رساند.
عملکرد نورون
تمام نورونها فارغ از نوع، سه عملکرد اساسی دارند:
دریافت پیام: جمعآوری (سیگنال) یا اطلاعات از محیط
ادغام سیگنالهای ورودی: خروجی این عملکرد، انتقال یا عدم انتقال پیام است.
انتقال پیام: دستور عملکردی از مغز، به سلولهای هدف منتقل میشود (هر سلولی میتواند سلول هدف باشد مثل سلولهای عضلانی، غدد یا نورونهای دیگر)]
ساختار نورون
ساختار نورون یا آناتومی آن، مانند سایر سلولها از یک بخش اصلی یا بدنه به نام جسم سلولی یا سوما تشکیل شده که هسته سلولیِ نورون را در بر گرفته است. نورونها نیاز به تولید مقدار فراوانی پروتئین دارند که بیشتر آنها در سوما ساخته میشوند. شبکه آندوپلاسمی دانهدار (خشن) در نورونها، ساختاری به نام جسم نیسل را به وجود آورده است که پروتئینهای مورد نیاز سلول عصبی را تولید میکند.
نورون ها از نظر ساختار، ۴ دسته هستند:
تکقطبی(1): پیام عصبی را فقط در یک جهت منتقل میکنند.
دوقطبی(2): یک آکسون و یک دندریت دارند.
چندقطبی(4): یک آکسون و ۲ یا تعداد بیشتری دندریت دارند.
فاقد آکسون: در این نوع نورون، آکسون و دندریت قابل تمایز از یکدیگر نیستند.
تکقطبی کاذب(3): دارای یک انشعاب که هم به عنوان آکسون هم دندریت عمل میکنند
-انواع پتانسیل غشا در نورون ها
پتانسیل غشا بر اساس غلظت یونها در خارج و داخل سلول نسبت به یکدیگر توصیف میشود که انواع این پتانسیلها عبارتند از:
پتانسیل آرامش: غشای سلول در حالت ریلکس و پایدار، دارای پتانسیل آرامش است.
پتانسیل عمل: هنگامی که سلول تحریک و دچار تغییر در پتانسیل غشا میشود. پتانسیل عمل مانند یک کلید دو حالته فقط دو حالت دارد یعنی یا کامل اتفاق میافتد یا اتفاق نمیافتد.
پتانسیل پسسیناپسی: پتانسیل پسسیناپسی دارای درجاتی است و توسط نوروترانسمیترهای نورون پیشسیناپسی، تقویت یا مهار میشود
سیگنال های عصبی
سیگنال های عصبی اغلب در مسافت های طولانی در بدن حرکت می کنند. به عنوان مثال ، اگر پا برهنه روی جسم تیز قدم بگذارید ، اطلاعات حسی از پای شما تا مغز منتقل می شود. از آنجا ، سیگنال های عصبی به عضلات پا برمی گردند و باعث انقباض آنها می شوند ، و پا را عقب می کشند. دهها نورون می توانند در چنین مدارهای مختلفی دخیل باشند ، بنابراین یک سیستم ارتباطی پیچیده برای انتقال سریع سیگنال ها بین سلول ها را ضروری می کند. همچنین ، از آنجا که طول سلولهای عصبی منفرد می تواند تا 3 فوت طول داشته باشد ، برای انتقال هر سیگنال از محلی که دریافت می شود ، به مکانی که به سلول همسایه منتقل می شود ، یک مکانیزم رله سریع درون خود نورون ها مورد نیاز است. دو مکانیزم برای انتقال سیگنال های عصبی تکامل یافته اند. ابتدا ، درون سلول ها ، سیگنال های الکتریکی در امتداد غشای سلول منتقل می شوند. دوم ، برای ارتباط بین سلول ها ، سیگنال های الکتریکی به طور کلی به سیگنال های شیمیایی منتقل شده توسط مولکول های کوچک پیام رسان به نام انتقال دهنده های عصبی تبدیل می شوند.
-انتقال سیگنال در سلولهای عصبی
مکانیسم اساسی انتقال سیگنال در داخل سلول های عصبی بر اساس اختلاف ولتاژ (یعنی پتانسیل ها) است که بین داخل و خارج سلول وجود دارد. این پتانسیل غشایی با توزیع ناهموار ذرات باردار الکتریکی یا یون ها ایجاد می شود که مهمترین آنها سدیم (〖Na〗^+) ، پتاسیم (K^+) ، کلرید (〖Cl〗^-) و کلسیم (〖Ca〗^(2+)) است. یونها از طریق کانالهای پروتئینی خاص در غشای سلول به سلول وارد و خارج می شوند. کانال ها در پاسخ به انتقال دهنده های عصبی یا تغییرات پتانسیل غشای سلول "باز" یا "بسته" می شوند. توزیع مجدد بار الکتریکی حاصل ممکن است اختلاف ولتاژ را در غشا تغییر دهد. کاهش اختلاف ولتاژ را دپولاریزاسیون می نامند. اگر دپلاریزاسیون از یک آستانه خاص فراتر رود ، یک تکانه (یعنی پتانسیل عمل) در امتداد نورون حرکت خواهد کرد. مکانیسم های مختلف اطمینان می دهند که پتانسیل عمل فقط در یک جهت ، به سمت نوک آکسون پخش می شود. از تولید یک پتانسیل عمل گاهی اوقات به عنوان "شلیک" یاد می شود.
انتقال سیگنال از طریق شکاف سیناپسی
اتصال انتقال دهنده های عصبی (به صورت مثلث نشان داده می شود) به گیرنده هایی که به عنوان کانال های یونی بسته به لیگاند عمل می کنند ، باعث باز شدن این کانال ها می شود و در بعضی موارد منجر به دپولاریزاسیون قسمت غشای نزدیک به کانال می شود. دپولاریزاسیون منجر به باز شدن کانالهای یونی دیگر می شود که به نوبه خود ممکن است یک پتانسیل عمل ایجاد کند. انتقال دهنده های عصبی (به صورت دایره نشان داده می شوند) که به گیرنده های متصل به پیام رسان دوم متصل می شوند ، یک آبشار پیچیده از حوادث شیمیایی را ایجاد می کنند که می تواند تغییراتی در عملکرد سلول ایجاد کند. در این شماتیک ، اولین جز چنین آبشار سیگنالینگ یک پروتئین G است.
-انتقال سیگنال بین سلول ها
ارتباط بین سلولهای عصبی معمولاً از طریق شکافهای میکروسکوپی رخ می دهد که شکاف سیناپسی نامیده می شود. هر نورون ممکن است با صدها هزار نورون دیگر ارتباط برقرار کند. نورون با ارسال سیگنال (به عنوان مثال ، یک نورون پیش سیناپسی) ماده ای شیمیایی به نام انتقال دهنده عصبی را آزاد می کند که به یک گیرنده در سطح نورون گیرنده (یعنی پس سیناپسی) متصل می شود. انتقال دهنده های عصبی از پایانه های پیش سیناپسی آزاد می شوند ، که ممکن است برای برقراری ارتباط با چندین نورون پس سیناپسی منشعب شوند. دندریت ها برای دریافت سیگنال های عصبی تخصص دارند ، اگرچه گیرنده ها ممکن است در جای دیگری از سلول واقع شوند. تقریباً 100 انتقال دهنده عصبی مختلف وجود دارد. هر نورون فقط یک یا چند نوع انتقال دهنده عصبی را تولید و آزاد می کند ، اما می تواند گیرنده ها را برای چندین نوع انتقال دهنده عصبی در سطح خود حمل کند.
برای عبور از شکاف سیناپسی ، پیام الکتریکی سلول باید به یک پیام شیمیایی تبدیل شود. این تبدیل زمانی اتفاق می افتد که یک پتانسیل عمل به نوک آکسون برسد و منجر به دپولاریزاسیون شود. دپولاریزاسیون باعث می شود 〖Ca〗^(2+) وارد سلول شود. افزایش غلظت 〖Ca〗^(2+) داخل سلولی باعث آزاد شدن مولکول های انتقال دهنده عصبی به شکاف سیناپسی می شود.
دو گروه بزرگ گیرنده وجود دارد که پاسخ های خاصی را در سلول گیرنده ایجاد می کند: گیرنده هایی که به عنوان کانال های یونی بسته به لیگاند عمل می کنند، منجر به پاسخ سریع اما کوتاه مدت می شوند ، در حالی که گیرنده های همراه با سیستم پیام رسان دوم پاسخ های کندتر اما طولانی تر را القا می کنند.
-سیگنال های الکتریکی سلول های عصبی
سلول های عصبی سیگنال های الکتریکی تولید می کنند که اطلاعات را منتقل می کنند. گرچه نورون ها ذاتاً رسانای خوبی برای الکتریسیته نیستند ، آنها مکانیسم های مفصلی را برای تولید سیگنال های الکتریکی بر اساس جریان یونها از غشای پلاسما تکامل داده اند. به طور معمول ، سلول های عصبی پتانسیل منفی به نام پتانسیل غشای استراحت ایجاد می کنند که می تواند با ثبت ولتاژ بین سلول های عصبی داخل و خارج اندازه گیری شود.
پتانسیل عمل ، پتانسیل استراحت منفی را از بین می برد و پتانسیل غشایی را به طور موقت مثبت می کند. پتانسیل های عمل در طول آکسون ها پخش می شوند و سیگنال اساسی هستند که اطلاعات را از یک مکان به مکان دیگر در سیستم عصبی منتقل می کنند. تولید هر دو پتانسیل استراحت و پتانسیل عمل را می توان از نظر نفوذ پذیری انتخابی سلول عصبی به یونهای مختلف و توزیع طبیعی این یونها در غشای سلول درک کرد.
-سیگنالهای الکتریکی الکتروکورتیکوگرافی ( ECOG) :
معمولاً در ثبت ECOG یک صفحهی الکترودی زیر جمجمه و روی قشر مغز قرار داده میشود. اگرچه به این روش نمیتوان نرخ آتش تکتک نورونها را اندازه گرفت و اینکه مانند EEG اندازهگیری میدان الکتریکی جمعیت نورونها ممکن است ولی هم SNR ( نسبت سیگنال به نویز) و هم رزولوشن مکانی آن از EEGبالاتر است. چراکه مستقیم از قشر مغز ثبت میشود، تلفات و پخششدگی ناشی از عبور از بافت و پوست سر را ندارد. معولا ECOG برای یافتن آن نواحی از سر که دچار حملات صرع میشوند ثبت میشود. حالآنکه تحقیقاتی نیز روی BCIتوسط دانشگاه میشیگان و با استفاده از این سیگنال انجامشده است . از دیدگاه حسگرهای زیستی موانع زیادی در دسترسی به فعالیت الکتریکی نورونهای مغز وجود دارد که طبیعتاً در مورد EEGاین موانع از همه کمتر است چراکه مطابق با نتایج پژوهش گروه نیل اسکوایر در %۳۱از پژوهشهای BCI از سیگنال EEG استفادهشده است.
-سیگنالهای مغزی الکتروانسفالوگرافی :EEG
نوار مغزی، ثبت فعالیت الکتریکی مغز است، این تکنیک شامل اخذ سیگنال توسط الکترودهای سطحی، بهبود سیگنال (معمولاً تقویت و حذف نویز)، چاپ سیگنال و آنالیز آن میشود. آنچه روی کاغذ چاپ میشود، الکتروانسفالوگرام نامیده میشود.
در این روش ثبت، تعدادي الكترود بر روي نقاط مختلف پوست سر و گردن فرد قرار داده میشود تا امواج ارسالي در اثر فعالیتهای نورونهای مغز را ثبت كند. این الكترودها كه از یكي از جنسهای نقره، پلاتین و ... ساخته میشوند به دو صورت خشك و یا همراه با ژل روي پوست سر قرار میگرند و در طي آزمایش به ثبت امواج دریافتي میپردازند. روش ثبت (EEG) در ابتدا بهترین روش براي تشخیص تومور، سكته مغزي و سایر مشكلات مربوط به مغز بود كه هماکنون با پیشرفت علم تصویربرداری پزشکی از مغزي ازجمله MRI CTscan , fMRI , یا سیستم تصویربرداری هستهای مانندPET ، سیگنالهای مغزی مزیت خود را ازدستدادهاند ولي فراموش نکنیم تمامی روشهای تصویربرداری از مغز هم به خاطر وارد شدن اشعه وهم رادیو داروهای مصرفی که برای بدن بیشازحد زیانآور میباشند و هزینههای استفاده بالا برای بیمار هنوز هم در موارد زیادي سیگنالهای مغزی کاربردهای فراوانی دارند .
نتایج حاصل از انسفالوگرافی را نمیتوان بهصورت مستقیم و تنها با مشاهده سیگنال موردبررسی و تفسیر قرارداد و از روی آن ناهنجاری را تشخیص داد. معمولاً طیف فرکانسی این سیگنال حاوی اطلاعات مفیدی است که کاربردهای تشخیصی تحقیقاتی زیادی دارد ازجمله موارد زیر:
کمک به تشخیص و تعیین محل آسیب مغزی سربرال
کمک به مطالعه صرع حملات گذرای برگشتپذیر عمل مغز دچار مشکل با حس نامنظم فعالیت حرکتی نظیر تشنج
کمک به تشخیص اختلالات روانی
کمک به مطالعه خواب
-سلول الکتروشیمیایی در مغز
نیتریک اکسید(NO) ، یک انتقال دهنده عصبی گازی ، می تواند به صورت الکتروشیمیایی در داخل مغز ایجاد شود و کانال های یونی کلسیم را فعال کند ، و زمینه را برای کاوشگرهای انتقال دهنده عصبی قابل کاشت فراهم می کند.
انتقال عصبی در سیستم عصبی مرکزی باعث تبادل اطلاعات بین سلولهای عصبی در مغز و بدن می شود. انتقال دهنده های عصبی مختلف در طی حوادث قبل و بعد از سیناپسی به طور مشترک در سیستم عصبی تولید و حمل و نقل می شوند. به عنوان مثال ، دوپامین نقش اصلی را در مکانیسم های پاداش بازی می کند. پروتون ها ، یون ها ، اسیدهای آمینه ، پپتیدها و مولکول های گازی (NO ، CO ، H_2 S) نیز می توانند به عنوان انتقال دهنده های عصبی عمل کنند.
این شبکه های شیمیایی پیچیده که از نظر مکانی و زمانی متفاوت هستند ، بسیار به هم پیوسته و اغلب ناپایدار هستند ، بنابراین نظارت یا کنترل درجه 1 چالش برانگیز است. فعال سازی نورون ها و نقشه برداری از اتصالات آنها با استفاده از آرایه های نانوالکترود و تصویربرداری نوری حاصل شده است. با این حال ، تحریک دقیق مناطق خاص مغز و تنظیم فعالیت آنها با تهیه مواد شیمیایی فعال بیولوژیکی ، به ویژه مولکول های گازی ، همچنان چالش برانگیز است.
اکسید نیتریک (NO) یک رادیکال محلول در آب ، ناپایدار است که با اکسیژن واکنش داده و اکسیدهای نیتروژن تشکیل می دهد. NO شناخته شده است که نقشهای متنوعی را در مسیرهای سیگنالینگ مربوط به هموستاز قلبی عروقی و پاسخهای ایمنی بازی می کند، اما در غلظت های بالا می تواند سمی باشد.
به دلیل ماهیت ناپایدار آن ، مطالعه سیگنالینگ NO در داخل بدن دشوارتر است.
با الهام از مسیرهای کاهش نیتریت بیولوژیکی (NO_2)، نویسندگان دستگاهی تولید کردند که از طریق کاهش نیتریت الکتروشیمیایی NO تولید می کند. با تغییر ولتاژ اعمال شده میزان تولید و مقدار NO قابل کنترل است. واکنش های کاهش NO_2 الکتروشیمیایی قبلاً برای تعادل چرخه نیتروژن بررسی شده است. با این حال ، بیشتر الکترودهای گزارش شده در درجه اول یون های آمونیوم تولید می کنند تا NO در محلول خنثی.
الکتروکاتالیست تولید کننده NO ، زمینه را برای طراحی یک کاوشگر تحویل NO-کاشت ، متشکل از دو الکترود میکرو سیم با قطر 50 میکرومتر ، جاسازی شده در یک الیاف پلی کربنات با قطر 400 میکرومتر فراهم می کند. در مرکز فیبر ، یک کانال میکرو سیال تنها امکان تأمین مداوم NO2– را فراهم می کند. این دستگاه الکتروشیمیایی کوچک و کاملاً یکپارچه می تواند در ناحیه شکمی مغز موش کاشته شود ، جایی که باعث افزایش محلی غلظت NO می شود ، که به نوبه خود عضو خانواده 1 وانیلیید گیرنده گذرا کانال 〖Ca〗^(2+)حساس به NO را فعال می کند .
TRPV 1 یک کانال 〖Ca〗^(2+)غیر انتخابی است که می تواند توسط چندین محرک برونزا و درون زا فعال شود. تجزیه و تحلیل فلورسنت تایید کرد که هجوم 〖Ca〗^(2+) داخل سلولی می تواند در پاسخ به ولتاژ اعمال شده تحریک شود. نکته مهم ، توزیع مکانی NO می تواند با تجزیه و تحلیل سینتیک انتشار کنترل شود و زمان هجوم 〖Ca〗^(2+)را می توان در محدوده 100 ثانیه کنترل کرد. بنابراین ، این پلت فرم تولید NO الکتروشیمیایی می تواند به راحتی به سایر کانال های یونی حساس به NO و گیرنده های NO درونزا گسترش یابد.
مبانی الکتروشیمیایی عملکرد عصب
غشایی که از یک لایه ی دو لایه لیپیدی تشکیل شده اند ، تمام سلولهای بدن و همچنین کلیه اندامک های درون سلول ها را در بر می گیرند. لیپید بودن این غشاها نسبت به یونهای کوچک و مولکولهای ماکرو نفوذ ندارد. انواع مختلفی از پروتئین های حمل و نقل ، که از میان صدها موجود در ژنوم انتخاب شده اند. در لایه دو لایه چربی قرار می گیرند تا عملکردهای خاصی را به یک نوع سلول یا سلول دیگر منتقل کنند. با هم ، این نوع سلول ها در سیستم عصبی برای مهار نیروهای الکتریکی و شیمیایی در تلاش برای جمع آوری اطلاعات ، تجزیه و تحلیل داده ها و رمزگذاری معنا به عنوان یک رشته از پتانسیل های عملکرد (AP ها) عمل می کنند. این فصل با بحث در مورد خصوصیات الکتریکی و شیمیایی اساسی محلول های یون های کوچک و پروتئین های بزرگ که از داخل سلول و اطراف آن تشکیل شده اند آغاز می شود و نشان می دهد که چگونه یک نورون از این نیروها برای اطمینان از یکپارچگی خود استفاده می کند - و چگونه باکتری ها و سیستم ایمنی بدن ما این دفاع ها را برای از بین بردن سلول های عصبی انجام می دهد. بعد ویژگی های الکتریکی عصب است که به ما امکان می دهد محیط خود را حس کنیم و داده های عصبی را ادغام کنیم. این فصل سپس با تغییرات فعال در غشای سلول عصبی که تولید AP برای رمزگذاری داده ها و ایجاد فعالیت های دور است ، پایان می یابد.
روشهای الکتروشیمیایی اعمال شده در علوم اعصاب
بخش زیر ، مجموعه ای مختصر از کارهای انجام شده با روشهای الکتروشیمیایی برای اندازه گیری ترشح از سلولهای منفرد است. این منطقه در سالهای اخیر بسیار رشد کرده و بررسی جامع آن در این فصل غیرممکن است. از این رو ، ما تلاش کرده ایم تا چند نمونه را که طعم دهنده انواع کارهایی است که می توان با این روش انجام داد ، مورد بحث قرار دهیم.
-مراحل ترشح در طی برون زدایی با آمپرومتری مشخص شده است
خارج شدن وزیکولهای هسته متراکم در مراحل مختلفی با باز شدن منافذ همجوشی ، انبساط تا اتساع کامل و تفکیک فرستنده از ماتریس هسته متراکم داخلی اتفاق می افتد که همگی نقش مهمی دارند. همه اینها با آزمایش آمپرسنجی بررسی شده است. افزایش قسمت سنبله جریان با باز شدن منافذ همجوشی ارتباط دارد. بر اساس مدل هایی که زمان افزایش شیب تیزتر از سنبله های آزمایش شده را پیش بینی می کنند ، گروه های آماتور و وایتمن نتیجه می گیرند که زمان افزایش "به دلیل یک مرحله جنبشی جداگانه است که به طور موقتی بین منافذ همجوشی تشکیل شده اولیه قرار دارد ، جایی که اکثر کاتکول آمین ها هستند. کاملاً با ماتریس همراه است ، و مرحله نهایی ، جایی که ماتریس جدا شده و انتشار کاتکول آمین ها کاملاً توسعه یافته است ". با استفاده از این تفسیر از افزایش بخش سنبله ، بنابراین ممکن است که برخی از دستکاری های منافذ همجوشی و / یا سرعت کاتکول آمین- تجزیه -کوراسیون ممکن است منجر به تغییر در زمان افزایش سنبله شود.
-نظریه های مربوط به نیروهایی که در گشودن منافذ همجوشی نقش دارند
میزان آزاد شدن فرستنده در طی برون زدایی کامل به سرعت باز شدن منافذ همجوشی بستگی دارد. پویایی منافذ توسط هر دو گیره-گیره و آمپومتری مورد مطالعه قرار گرفته است. بر اساس مطالعات آمپومتریک برون ریزشی از سلولهای کرومافین آدرنال ، یک مدل فیزیکوشیمیایی با توصیف دقیق پویایی وقایع همجوشی کامل از وزیکولهای هسته متراکم ارائه شده است. این مدل پیش بینی می کند که ماتریس وزیکولیک نقش تعیین کننده ای در باز شدن وزیکول در مرحله نهایی برون ریزشی دارد. به محض باز شدن منافذ همجوشی ، شیب غلظت کاتیونهای کاتکول آمین (عمدتا اپی نفرین در سلولهای کرومافین) انتشار خارجی آنها را تحریک می کند. برای حفظ خنثی بودن الکترون در ماتریس ، این امر با ورود کاتیونهای خارج سلولی ، هیدراته و یک ظرفیتی مانند Na^+ و H^+ به داخل ماتریکس داخل سلولی همراه است. معمولاً در نظر گرفته می شود که در طی این مرحله ، منافذ همجوشی هنوز گسترش نیافته است ، بلکه بین فازهای باز و بسته در نوسان است. هندسه آن ممکن است توسط یک معماری خاص تحمیل شود ، که هنوز هم مورد بحث است ، احتمالاً مجتمع های پروتئینی SNARE یا فسفولیپیدها یا ترکیبی از هر دو را درگیر می کند. با این حال ، در این مرحله ، ممکن است در نظر گرفته شود که انرژی منافذ لزوماً توسط دو پدیده مخالف کنترل می شود. مورد اول مثبت است و تمایل به بسته شدن منافذ دارد. انعکاس دهنده انرژی لبه لبه منافذ است. مورد دوم منفی است و تمایل به باز کردن منافذ دارد. این از تنشهای لاپلاس در غشای سلول و وزیکول ناشی می شود. در ابتدا ، انرژی لبه بزرگتر از انرژی سطح است تا منافذ پایدار بمانند. به دلیل تبادل کاتیونی مداوم ، که به محض باز شدن منافذ رخ می دهد ، ماتریس متورم می شود.
تنظیم انسولین اکسوسیتوز از سلولهای بتا پانکراس
یک سری آزمایشات انجام شده با سلولهای β پانکراس ، آزمایش تاکاشی و همکاران بود. برای بررسی برونشستگی سریع و آهسته. گفته می شود این در دو نوع مختلف وزیکول انجام می شود: وزیکول های کوچک شفاف ، وزیکول های هسته بزرگ و متراکم. گزارش شده است که وزیکول های کوچک شفاف تحت رهاسازی سریع قرار می گیرند. در آنجا ، هسته بزرگ متراکم وزیکول به سمت آزاد شدن کندتر تمایل دارد. وزیکول های هسته متراکم ، از جمله چیزهای دیگر ، حاوی پپتید پلی یونیک به نام کروموگرانین A هستند. همانطور که در بالا بحث شد ، این فرضیه مبنی بر اتصال انتقال دهنده های عصبی در این وزیکول ها در داخل هسته متراکم وجود دارد. با همجوشی اولیه وزیکول با غشای پلاسما ، هسته متراکم ، که در محیط pH پایین وزیکول است ، در معرض محیط اساسی تر خارج سلول قرار گرفته و باعث جدا شدن و آزاد سازی مولکول های انتقال دهنده عصبی می شود. فرضیه کار این است که گره گشایی از هسته متراکم زمان محدودی طول می کشد و بنابراین زمان برون ریز سازی را افزایش می دهد. به منظور تمایز بین دو نوع وزیکول ، سنبله های آمپرومریک مقایسه شد. میانگین اختلاف زمانی بین گروهی از وقایع با سرعت آهسته و گروهی 1.5 ثانیه بود ، تفاوت زمانی که آمپرومتری دارای تفکیک پذیری ث میلی ثانیه است به راحتی متمایز می شود. Ca^(2+)نقش زیادی در سیگنالینگ سلولی برای برون گسیختگی دارد ، و به منظور کنترل هجوم Ca^(2+)در این آزمایش ، از Ca^(2+) در قفس آزاد شده با عکس استفاده شد. حوادث انتشار آهسته و سریع نیز با استفاده از تکنیک های پچ گیره کنترل شد .


اشتراک
گزارش
نظرات من